Jena/Pisa. Die postnatale Entwicklung des Gehirns ist nach der Geburt durch zeitlich begrenzte, funktionsspezifische Fenster hoher Plastizität gekennzeichnet (kritische o. sensible Phasen). Diese lernsensiblen Phasen treten auf, indem bestimmte Bereiche des Gehirns durch Reifungs- und Differenzierung-Prozesse weiter ausgebaut werden und somit leicht und schnell neuronale Verknüpfungen entstehen, die die Plastizität des Gehirns erhöhen. Der natürliche Spracherwerb bei Säuglingen ist das bekannteste Beispiel für so eine sensible Phase.
Die neuronale Plastizität gibt unserem Gehirn die Möglichkeit, sich das ganze Leben lang an neue Anforderungen anzupassen. Sie ist im erwachsenen Gehirn jedoch oft eingeschränkt, so dass Lernprozesse mühsamer ablaufen. Um zelluläre und molekulare Mechanismen zu identifizieren, die diese sensiblen Phasen öffnen und wieder schließen und im Zusammenhang mit dem Altern stehen, untersuchten Forscher der Scuola Normale Superiore (SNS) in Pisa, Italien, in Kooperation mit dem Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut (FLI) in Jena und weiteren Partnern die Plastizität der visuellen Hirnrinde (visueller Kortex) bei Mäusen.
Plastizität des visuellen Kortex
„Verbindungen in der visuellen Hirnrinde passen sich in kritischen Entwicklungsphasen maximal an visuelle Reize an. Das erlaubt uns, wichtige Regulatoren der Gehirnplastizität zu identifizieren“, berichten die beiden Seniorautoren der im Journal „EMBO Reports“ veröffentlichten Studie, Prof. Alessandro Cellerino, SNS und assoziierter Gruppenleiter am FLI in Jena und Prof. Tommaso Pizzorusso, Universität Florenz und Institut für Neurowissenschaften, NRC, in Pisa. Eine These geht davon aus, dass die Plastizität der Augendominanz mit dem Alter passiv abklingt; es wird jedoch immer deutlicher, dass die Plastizitätsniveaus durch Regulation alterns- und erfahrungsabhängiger molekularer Prozesse festgelegt werden, die die Plastizität der Schaltkreise entweder aktiv fördern oder unterdrücken ("Plastizitätsbremsen").
„Visuell-kortikale Schaltkreise, die zum visuellen System zählen und das Sehen ermöglichen, weisen während des frühen Lebens eine starke Plastizität auf und werden später durch molekulare Bremsen stabilisiert, die eine übermäßige Anpassung von Verknüpfungen über einen kritischen Zeitraum hinaus begrenzen“, erläutert Prof. Cellerino. Die zugrundeliegenden Mechanismen, die die Expression dieser Faktoren während des Übergangs von der Entwicklung bis zum Erwachsenenalter koordinieren, sind jedoch noch unbekannt.
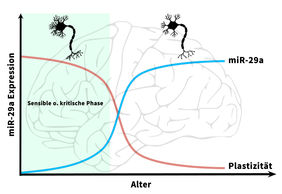
miR-29 - altersabhängige Steuerung der Plastizität im visuellen Kortex
Um Faktoren zu identifizieren, die die postnatale Entwicklung des visuellen Kortex regulieren, wurden miRNA/RNA-Datensätze vom sich entwickelnden visuellen Kortex von Mäusen analysiert und zu unterschiedlichen Zeitpunkten miteinander verglichen: P10, Tag 10 nach der Geburt und unmittelbar vor der Augenöffnung sowie dem Einsetzen der sensiblen Phase, und P28, wenn der Mäusekortex seine funktionelle Reife erreicht hat.
Es gelang der Nachweis der microRNA-Familie miR-29 als einen altersabhängigen Regulator der Entwicklungsplastizität im visuellen Kortex. „Mit einem 30-fachen Anstieg war miR-29a die am stärksten hochregulierte miRNA während der sensiblen Phase“, erklärt Prof. Cellerino vom FLI/SNS. Die Regulation der miR-29-Familie ist in Fischen, Mäusen und Menschen auffallend konserviert. Darüber hinaus wurden mehr als die Hälfte der von miR-29-regulierten Ziele mit dem Alter herunterreguliert, einschließlich der Schlüsselregulatoren der Gehirnplastizität. Ein Hinweis darauf, dass miR-29a ein wichtiger Regulator nachgeschalteter Entwicklungsprozesse im Gehirn ist.
Re-Modellierung der Plastizität
Weitere Untersuchungen zeigten, dass ein vorzeitiger Anstieg der miR-29a-Konzentrationen in jungen Mäusen die jugendliche Augendominanz-Plastizität blockierte und ein frühes Auftreten perineuronaler Netze (PPNs) verursachte. PPNs sind spezialisierte Strukturen im zentralen Nervensystem, die für die synaptische Stabilisierung im erwachsenen Gehirn verantwortlich sind. Im sich entwickelnden sowie erwachsenen Gehirn spielen sie als Plastizitätsbremse eine entscheidende Rolle und halten bestehende Verbindungen zwischen Nervenzellen aufrecht.
Darüber hinaus konnten die Forscher zeigen, dass die Blockierung von miR-29a in adulten Tieren die entwicklungsbedingte Herunterregulierung der miR-29a-Ziele umkehrte und eine Form der das Auge betreffenden (okulären) Plastizität induzierte, die mit typischer physiologischer und molekularer Signatur der Plastizität in sensiblen Phasen ausgestattet war.
Zusammenfassend weisen die jetzt im Journal „EMBO Reports“ veröffentlichten Daten darauf hin, dass miR-29a ein wichtiger Regulator der Plastizitätsbremsen ist, der die altersabhängige Stabilisierung der visuellen kortikalen Verbindungen fördert. Die Beobachtung, dass miR29a ein Re-Modellierer ausgereifter neuronaler Netze ist, eröffnet neue, hoffnungsvolle therapeutische Perspektiven für miR-29a und andere miR-29-Familienmitglieder, um die Plastizität während des Alterns und die Regeneration von Hirnschädigungen zu fördern.
Publikation
Debora Napoli, Leonardo Lupori, Raffaele Mazziotti, Giulia Sagona, Sara Bagnoli, Muntaha Samad, Erika Kelmer Sacramento, Joanna Kirkpartick, Elena Putignano, Siwei Chen, Eva Terzibasi Tozzini, Paola Tognini, Pierre Baldi, Jessica CF Kwok, Alessandro Cellerino, Tommaso Pizzorusso. MiR‐29 coordinates age‐dependent plasticity brakes in the adult visual cortex. EMBO Rep (2020) e50431. DOI: 10.15252/embr.202050431.
Kontakt
Dr. Kerstin Wagner
Presse- und Öffentlichkeitsarbeit
Tel.: 03641-656378, E-Mail: presse@leibniz-fli.de