Jena. In vielen Geweben reagieren Stammzellen auf Gewebeschäden, indem sie ihre Proliferationsrate erhöhen und neue differenzierte Zellnachkommen produzieren. Der Erhalt des Gleichgewichtszustands zwischen Zellverlust und Zellerneuerung (Gewebs-Homöostase) durch strikte Kontrolle der Stammzellteilung garantiert den Erhalt der Organgröße und Organfunktion. Daher ist in adulten Stammzelllinien die präzise Differenzierung von Tochterzellen für die Entwicklung und Aufrechterhaltung der Gewebs-Homöostase entscheidend. Schleichen sich Fehlfunktionen in die Stammzellen ein, dann funktioniert der Prozess nicht mehr reibungslos: Gewebe können degenerieren und Krebs kann entstehen.
Um die Differenzierung adulter Stammzellen in der Gewebs-Homöostase zu untersuchen, nutzen Forscher den Mitteldarm der Fruchtfliege (Drosophila melanogaster) als Modellsystem, da er funktionell und strukturell dem des menschlichen Darms sehr ähnlich ist. Bei Verletzungen oder Infektionen, die zu Schäden in der Darmschleimhaut führen, erhöht sich die Zellteilungsaktivität der intestinalen Stammzellen (ISCs), um geschädigte Zellen schnell zu ersetzen und das Gleichgewicht wiederherzustellen. Eine Fehlsteuerung der Zellspezifikation bzw. Differenzierung kann dabei zu einer erheblichen Funktionsstörung führen, was beispielsweise im alternden Darm zu beobachten ist. Wie die Steuerung der Zelldifferenzierung im Detail funktioniert, war bisher unklar.
Forscher des Leibniz-Instituts für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena haben zusammen mit Kollegen des Buck Institute for Research on Aging, Novato, USA, am Modellorganismus der Fruchtfliege diesen Mechanismus der Zellerneuerung im Darm untersucht. „Durch die Stammzellen ist der Darm in der Lage, sich stetig zu regenerieren und während der Lebensdauer des Organismus die Funktion und Integrität des Gewebes abzusichern“, erklärt Dr. Jerome Korzelius, Erstautor der Studie in „Nature Communications“.
Asymmetrische Zellteilung intestinaler Stammzellen
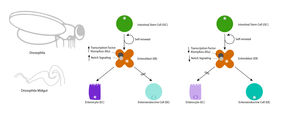
Hinter dem Prozess der Zellerneuerung steckt die asymmetrische Zellteilung von ISCs: D.h., aus einer Stammzelle entsteht wieder eine Stammzelle, die für die Aufrechterhaltung der Funktion wichtig ist und ein Enteroblast (EB), eine Vorläuferzelle, aus der sich dann - je nach vorherrschender Signalkaskade - verschiedene differenzierte Tochterzellen entwickeln können. Aus den EBs entstehen so entweder Enterozyten (EC), die für die Nährstoffgewinnung aus der Nahrung (Resorption), aber auch für die Immunabwehr verantwortlich sind, oder enteroendokrine Zellen (EE), die zur Bildung von Hormonen dienen und die Signalvermittlung im Gewebe ermöglichen. Jüngste Arbeiten zeigten, dass die Linienspezifikation in diesen EB-Tochterzellen jedoch viel komplexer ist, als bisher angenommen.
Transkriptionsfaktor Klumpfuss als Regulator
Die Wissenschaftler fanden heraus, dass der Transkriptionsfaktor Klumpfuss (Klu), der mit dem Säugetier-Tumorsuppressorgen „Wilms' Tumor 1“ (WT1) verwandt ist, im erwachsenen Drosophila-Darm eine besondere Rolle bei der Linienwahl der Enteroblasten (EBs) spielt. „Wir konnten nachweisen, dass der Transkriptionsfaktor Klu in den Enteroblasten vorkommt und seine Aktivität die Zellteilung in Richtung der Enterozytenlinie steuert,“ erläutert Dr. Korzelius, der mittlerweile am Max-Planck-Institut für Biologie des Alterns in Köln tätig ist. Klu unterdrückt die Differenzierung der EBs in enteroendokrine Zellen (EEs), indem es die Gene herunterreguliert, die für die EE-Differenzierung notwendig sind. Bei Verlust von Klu in den Enteroblasten erfolgt eine Differenzierung der EBs in EE-Zellen.
Wechselspiel Notch-Signalisierung
Des Weiteren fanden die Forscher, dass Klu zusammen mit der Notch-Signalisierungskaskade sowohl bei der Teilung der ISCs als auch bei der Differenzierung der Zellen eine zentrale Rolle spielt. ISCs produzieren den Notch-Liganden Delta und aktivieren Notch in der Enteroblasten-Tochterzelle, dem Vorläufer reifer Enterozyten. Der Verlust von Notch in ISC-Linien führt zur Bildung von Tumoren; wahrscheinlich als Folge einer gestörten EB-Differenzierung; verbunden mit einer erhöhten Häufigkeit symmetrischer Teilungen und einer übermäßigen EE-Differenzierung. Bei der EB-Differenzierung agiert der Transkriptionsfaktor Klu so, dass er die Expression von Notch-Zielgenen präzise kontrolliert. Die Kontrolle von Notch-Zielgenen durch Klu fügt sich als weitere Regulationsebene in dieses komplexe Zusammenspiel ein, das auch bei vielen Krankheiten des Menschen eine wichtige Rolle spielt.
„Unsere Ergebnisse geben einen mechanistischen Einblick in die Art und Weise, wie die Zelldifferenzierung im Darm der Fruchtfliege geregelt ist“, fasst Dr. Heinrich Jasper, Seniorautor der Studie, die jüngsten Ergebnisse zusammen. Das sind wichtige Einblicke in die Kontrolle der Gewebereparatur und -regeneration, die auch für den Bereich der Säugetiere, einschließlich des Menschen, interessant sind.
Publikation
The WT1-like transcription factor Klumpfuss maintains lineage commitment of enterocyte progenitors in the Drosophila intestine. Korzelius J, Azami S, Ronnen-Oron T, Koch P, Baldauf M, Meier E, Rodriguez-Fernandez IA, Groth M, Sousa-Victor P, Jasper H. Nat Commun. 2019 10(1), 4123. doi: 10.1038/s41467-019-12003-0.
Kontakt
Dr. Kerstin Wagner
Presse- und Öffentlichkeitsarbeit, Tel.: 03641-656378, E-Mail: presse@leibniz-fli.de