Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
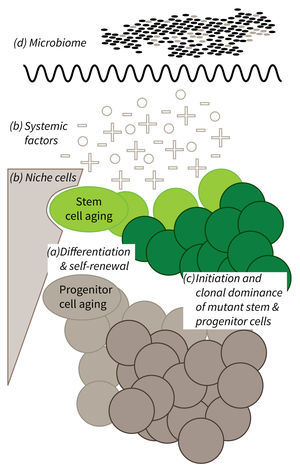
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2025
- How I diagnose and treat patients in the pre-fibrotic phase of primary myelofibrosis (pre-PMF) - practical approaches of a German expert panel discussion in 2024.
Griesshammer M, Al-Ali HK, Eckardt JN, Fiegl M, Göthert J, Jentsch-Ullrich K, Koschmieder S, Kvasnicka HM, Reiter A, Schmidt B, Heidel FH
Ann Hematol 2025 (epub ahead of print) - Novel translational mouse models of metabolic dysfunction-associated steatotic liver disease comparable to human MASLD with severe obesity.
Hupa-Breier KL, Schenk H, Campos-Murguia A, Wellhöner F, Heidrich B, Dywicki J, Hartleben B, Böker C, Mall J, Terkamp C, Wilkens L, Becker F, Rudolph KL, Manns MP, Mederacke YS, Marhenke S, Redeker H, Lieber M, Iordanidis K, Taubert R, Wedemeyer H, Noyan F, Hardtke-Wolenski M, Jaeckel E
Mol Metab 2025 (epub ahead of print) - Cell-free DNA for detection and monitoring of extramedullary AML relapse.
Hupe HC, Wienecke CP, Bartels S, Schipper E, Leßmann J, Lasch A, Bader M, Gabdoulline R, Neugebohren M, Dammann E, Kreipe HH, Lehmann U, Bergmann AK, Di Donato N, Stadler M, Eder M, Ganser A, Heidel FH, Thol F, Heuser M
Hemasphere 2025, 9(3), e70097 - Pathogenesis and management of high molecular risk myeloproliferative neoplasms.
Ling VY, Heidel FH, Bywater MJ
Haematologica 2025, 110(4), 863-76 - Infection and herbicide exposure implicate c-Abl kinase in α-Synuclein Ser129 phosphorylation
Marzieh E, Zeyang S, Alvaro QO, Gesa R, Mahdi R, David H, Saskia FE, Thomas FM
bioRxiv 2025, https://doi.org/10.1101/2025.01. - Malignant JAK-signaling: at the interface of inflammation and malignant transformation.
Perner F, Pahl HL, Zeiser R, Heidel FH
Leukemia 2025 (epub ahead of print) - Anti-CD19 CAR-T cell therapy for acquired hemophilia A.
Schultze-Florey CR, Thol FR, Aleksandrova K, Stoyanov K, Gutierrez Jauregui R, Arseniev L, Leise J, Klöß S, Heidel** FH, Tiede** A
Leukemia 2025, 39(4), 980-2 ** co-corresponding authors
2024
- Imetelstat-mediated alterations in fatty acid metabolism to induce ferroptosis as a therapeutic strategy for acute myeloid leukemia.
Bruedigam C, Porter AH, Song A, Vroeg In de Wei G, Stoll T, Straube J, Cooper L, Cheng G, Kahl VFS, Sobinoff AP, Ling VY, Jebaraj BMC, Janardhanan Y, Haldar R, Bray LJ, Bullinger L, Heidel FH, Kennedy GA, Hill MM, Pickett HA, Abdel-Wahab O, Hartel G, Lane SW
Nat Cancer 2024, 5(1), 47-65 - Dietary restriction interventions: lifespan benefits need resilience and are limited by immune compromise and genetics.
Chen Y, Malik A, Rudolph KL
Signal Transduct Target Ther 2024, 9(1), 335 - Dominant immune tolerance in the intestinal tract imposed by RelB-dependent migratory dendritic cells regulates protective type 2 immunity.
Geiselhöringer AL, Kolland D, Patt AJ, Hammann L, Köhler A, Kreft L, Wichmann N, Hils M, Ruedl C, Riemann M, Biedermann T, Anz D, Diefenbach A, Voehringer D, Schmidt-Weber CB, Straub T, Pasztoi M, Ohnmacht C
Nat Commun 2024, 15(1), 9143