Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
Forschungsfokus von Teilbereich 1.
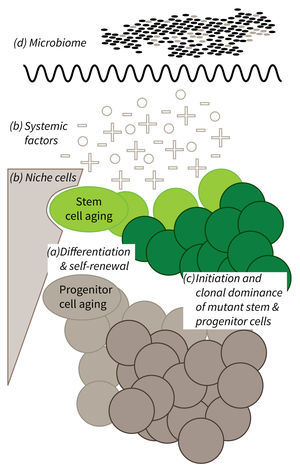
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2024
- We need to talk-how muscle stem cells communicate.
Majchrzak K, Hentschel E, Hönzke K, Geithe C, von Maltzahn J
Front Cell Dev Biol 2024, 12, 1378548 - Optimizing Biocompatibility and Gene Delivery with DMAEA and DMAEAm: A Niacin-Derived Copolymer Approach.
Mapfumo PP, Reichel LS, André T, Hoeppener S, Rudolph LK, Traeger A
Biomacromolecules 2024 (epub ahead of print) - Vitamin B3 Containing Polymers for Nanodelivery.
Mapfumo PP, Solomun JI, Becker F, Moek E, Leiske MN, Rudolph LK, Brendel JC, Traeger A
Macromol Biosci 2024, e2400002 - Oncogenic Calreticulin Induces Immune Escape by Stimulating TGFβ Expression and Regulatory T-cell Expansion in the Bone Marrow Microenvironment.
Schmidt D, Endres C, Hoefflin R, Andrieux G, Zwick M, Karantzelis N, Staehle HF, Vinnakota JM, Duquesne S, Mozaffari Jovein M, Pfeifer D, Becker H, Blazar BR, Zähringer A, Duyster J, Brummer T, Boerries M, Baumeister J, Shoumariyeh K, Li J, Green AR, Heidel FH, Tirosh I, Pahl HL, Leimkühler N, Köhler N, de Toledo MAS, Koschmieder S, Zeiser R
Cancer Res 2024, 84(18), 2985-3003 - Consequences of GMPPB deficiency for neuromuscular development and maintenance.
Schurig MK, Umeh O, Henze* H, Jung* MJ, Gresing L, Blanchard V, von Maltzahn J, Hübner* CA, Franzka* P
Front Mol Neurosci 2024, 17, 1356326 * equal contribution - Pyjacker identifies enhancer hijacking events in acute myeloid leukemia including MNX1 activation via deletion 7q
Sollier E, Riedel A, H.Toprak U, A.Wierzbinska J, Weichenhan D, Philipp Schmid J, Hakobyan M, Touzart A, Jahn E, Vick B, Brown-Burke F, Kelly K, Kelekci S, Pejkovska A, Goyal A, Bähr M, Breuer K, May Chen MJ, Llamazares-Prada M, Hartmann M, Schönung M, Correia N, Trumpp A, Abdullah Y, Klingmüller U, S.Mughal S, Brors B, Westermann F, Schlesner M, Vosberg S, Herold T, A.Greif P, Pfeifer D, Lübbert M, Fischer T, H.Heidel F, Gebhard C, Walter W, Haferlach T, Eisfeld AK, Mrózek K, Nicolet D, Bullinger L, Smeenk L, Erpelinck C, Mulet-Lazaro R, Delwel R, Ernst A, Scherer M, Lutsik P, Jeremias I, Döhner K, Döhner H, B.Lipka D, Plass C
bioRxiv 2024, https://doi.org/10.1101/2024.09. - Leiomodin 1 promotes myogenic differentiation by modulating Sirtuin 1
Späth* E, C.Schüler* S, Heinze I, Dau T, Minetti A, Hofmann M, von Maltzahn** J, Ori** A
bioRxiv 2024, https://doi.org/10.1101/2024.03. * equal contribution, ** co-corresponding authors - Resident and recruited macrophages differentially contribute to cardiac healing after myocardial ischemia.
Weinberger T, Denise M, Joppich M, Fischer M, Garcia Rodriguez C, Kumaraswami K, Wimmler V, Ablinger S, Räuber S, Fang J, Liu L, Liu WH, Winterhalter J, Lichti J, Thomas L, Esfandyari D, Percin G, Matin S, Hidalgo A, Waskow C, Engelhardt S, Todica A, Zimmer R, Pridans C, Gomez Perdiguero E, Schulz C
Elife 2024, 12, RP89377 - Aggregates of nonmuscular myosin IIA in erythrocytes associate with GATA1- and GFI1B-related thrombocytopenia.
Zaninetti C, Rivera J, Vater L, Ohlenforst S, Leinøe E, Böckelmann D, Freson K, Thiele T, Makhloufi H, Rath M, Eberl W, Wolff M, Freyer C, Wesche J, Zieger B, Felbor U, Heidel FH, Greinacher A
J Thromb Haemost 2024, 22(4), 1179-86 - Immunofluorescence microscopy on the blood smear identifies patients with myeloproliferative neoplasms.
Zaninetti C, Vater L, Kaderali L, Crodel CC, Schnöder TM, Fuhrmann J, Swensson L, Wesche J, Freyer C, Greinacher A, Heidel FH
Leukemia 2024 (epub ahead of print)