Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
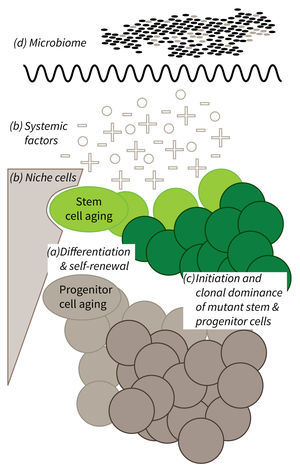
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2017
- Nicotinamide adenine dinucleotide replenishment rescues colon degeneration in aged mice.
Zhu X, Shen W, Wang Y, Jaiswal A, Ju Z, Sheng Q
Signal Transduct Target Ther 2017, 2, 17017
2016
- Xpg limits the expansion of haematopoietic stem and progenitor cells after ionising radiation.
Avila AI, Illing A, Becker F, Maerz LD, Morita Y, Philipp M, Burkhalter MD
Nucleic Acids Res 2016, 44(13), 6252-61 - Metabolic regulation of stem cell function in tissue homeostasis and organismal ageing.
Chandel NS, Jasper H, Ho TT, Passegué E
Nat Cell Biol 2016, 18(8), 823-32 - You Are What You Eat: Linking High-Fat Diet to Stem Cell Dysfunction and Tumorigenesis.
Haller S, Jasper H
Cell Stem Cell 2016, 18(5), 564-6 - Gene Dosage Reductions of Trf1 and/or Tin2 Induce Telomere DNA Damage and Lymphoma Formation in Aging Mice.
Hartmann K, Illing A, Leithäuser F, Baisantry A, Quintanilla-Fend L, Rudolph KL
Leukemia 2016, 30(3), 749-53 - Wnt/β-catenin signaling via Axin2 is required for myogenesis and, together with YAP/Taz and Tead1, active in IIa/IIx muscle fibers.
Huraskin D, Eiber N, Reichel M, Zidek LM, Kravic B, Bernkopf D, von Maltzahn J, Behrens J, Hashemolhosseini S
Development 2016, 143(17), 3128-42 - Telomere shortening leads to earlier age of onset in ALS mice.
Linkus B, Wiesner D, Meßner M, Karabatsiakis A, Scheffold A, Rudolph KL, Thal DR, Weishaupt JH, Ludolph AC, Danzer KM
Aging (Albany NY) 2016, 8(2), 382-93 - Intestinal IRE1 Is Required for Increased Triglyceride Metabolism and Longer Lifespan under Dietary Restriction.
Luis NM, Wang L, Ortega M, Deng H, Katewa SD, Li PWL, Karpac J, Jasper** H, Kapahi** P
Cell Rep 2016, 17(5), 1207-16 ** co-corresponding authors - Loss of fibronectin from the aged stem cell niche affects the regenerative capacity of skeletal muscle in mice.
Lukjanenko L, Jung MJ, Hegde N, Perruisseau-Carrier C, Migliavacca E, Rozo M, Karaz S, Jacot G, Schmidt M, Li L, Metairon S, Raymond F, Lee U, Sizzano F, Wilson DH, Dumont NA, Palini A, Fässler R, Steiner P, Descombes P, Rudnicki MA, Fan CM, von Maltzahn J, Feige JN, Bentzinger CF
Nat Med 2016, 22(8), 897-905 - Kinomics Screening Identifies Aberrant Phosphorylation of CDC25C in FLT3-ITD-positive AML.
Perner F, Schnöder TM, Fischer T, Heidel FH
Anticancer Res 2016, 36(12), 6249-58