Teilbereich 1: Altern von Stammzellen
Die Forschungsgruppen innerhalb des Teilbereichs 1 untersuchen die Ursachen und Folgen der Stammzellalterung. Die Forschungsarbeit erstreckt sich von Modellorganismen über genetische Mausmodelle bis hin zu Mausmodellen, die mit menschlichen Stammzellen angereichert sind.
Mit der Schließung von zwei Gruppen in 2016 ist die Stammzellforschung an Wirbellosen-Modellen im Teilbereich 1 reduziert. Das Institut geht davon aus, dass mit der Rekrutierung neuer Gruppen diese Lücke geschlossen warden kann.
Die Forschung ist durch vier Schwerpunkte definiert:
- Zellintrinsische Mechanismen, die die Funktion alternder Stamm- und Vorläuferzellen einschränken,
- Alternsbedingte Veränderungen der Stammzellnischen und des systemischen Umfelds,
- Mechanismen der klonalen Selektion und epigenetische Drifts bei der Stammzellalterung und
- Mikrobiota- und stoffwechselbedingte Beeinträchtigungen der Stammzellfunktion während des Alterns (im Zusammenhang mit dem neuen Schwerpunkt Mikrobiota und Altern, der ím Teilbereich 2 aufgebaut wird).
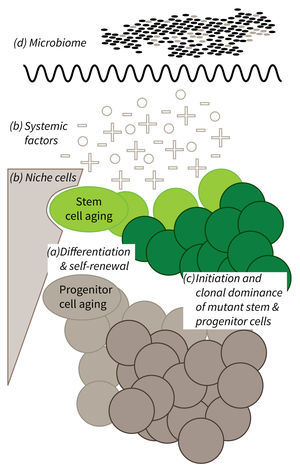
Forschungsfokus von Teilbereich 1.
a) Derzeit ist noch nicht vollständig bekannt, welche Mechanismen die Zellfunktionen im Alter beeinträchtigen. b) Der relative Einfluss von Nischenzellen und systemisch wirkenden Faktoren auf die Stammzellalterung müssen für verschiedene Gewebe noch erforscht werden. c) Die klonale Ausbreitung mutanter Zellen wird mit der Entstehung von Krankheiten im Alter in Verbindung gebracht. Mechanistisch ist der Prozess jedoch noch kaum verstanden. Die Veränderungen in der Farbintensität stehen für die klonale Dominanz von ursprünglichen Stamm- (grün) und Vorläuferzellen (grau). d) Es gibt zunehmend Hinweise darauf, dass alternsbedingte Veränderungen im Mikrobiom die Stammzellfunktion beeinflussen und vice versa.
Publikationen
(seit 2016)
2018
- Influence of Scribble polarity complex on hematopoiesis and leukemia - a matter of where, when and how.
Heidel FH, Ellis S
Oncotarget 2018, 9(78), 34642-3 - RelB regulates Th17 differentiation in a cell-intrinsic manner.
Koliesnik IO, Andreas N, Romanov VS, Sreekantapuram S, Krljanac B, Haenold R, Weih F
Immunobiology 2018, 223(2), 191-9 - Epigenetic Erosion in Adult Stem Cells: Drivers and Passengers of Aging.
Kosan C, Heidel FH, Godmann M, Bierhoff H
Cells 2018, 7(12) - Thyroid Hormone Transporters MCT8 and OATP1C1 Control Skeletal Muscle Regeneration.
Mayerl S, Schmidt M, Doycheva D, Darras VM, Hüttner SS, Boelen A, Visser TJ, Kaether C, Heuer** H, von Maltzahn** J
Stem Cell Reports 2018, 10(6), 1959-74 ** co-corresponding authors - The cell fate determinant Scribble is required for maintenance of hematopoietic stem cell function.
Mohr J, Dash BP, Schnoeder TM, Wolleschak D, Herzog C, Tubio Santamaria N, Weinert S, Godavarthy S, Zanetti C, Naumann M, Hartleben B, Huber TB, Krause DS, Kähne T, Bullinger L, Heidel FH
Leukemia 2018, 32(5), 1211-21 - Reduced expression of C/EBPβ-LIP extends health- and lifespan in mice.
Müller* C, Zidek* LM, Ackermann T, de Jong T, Liu P, Kliche V, Zaini MA, Kortman G, Harkema L, Verbeek DS, Tuckermann JP, von Maltzahn J, de Bruin A, Guryev V, Wang ZQ, Calkhoven CF
Elife 2018, 7, e34985 * equal contribution - CSF1R regulates the dendritic cell pool size in adult mice via embryo-derived tissue-resident macrophages.
Percin GI, Eitler J, Kranz A, Fu J, Pollard JW, Naumann R, Waskow C
Nat Commun 2018, 9(1), 5279 - Dysregulation of chemokine receptor expression and function in leukocytes from ALS patients.
Perner C, Perner F, Stubendorff B, Förster M, Witte OW, Heidel FH, Prell T, Grosskreutz J
J Neuroinflammation 2018, 15(1), 99 - Oncogenic JAK2V617F causes PD-L1 expression, mediating immune escape in myeloproliferative neoplasms.
Prestipino A, Emhardt AJ, Aumann K, O'Sullivan D, Gorantla SP, Duquesne S, Melchinger W, Braun L, Vuckovic S, Boerries M, Busch H, Halbach S, Pennisi S, Poggio T, Apostolova P, Veratti P, Hettich M, Niedermann G, Bartholomä M, Shoumariyeh K, Jutzi JS, Wehrle J, Dierks C, Becker H, Schmitt-Graeff A, Follo M, Pfeifer D, Rohr J, Fuchs S, Ehl S, Hartl FA, Minguet S, Miething C, Heidel FH, Kröger N, Triviai I, Brummer T, Finke J, Illert AL, Ruggiero E, Bonini C, Duyster J, Pahl HL, Lane SW, Hill GR, Blazar BR, von Bubnoff N, Pearce EL, Zeiser R
SCI TRANSL MED 2018, 10(429) - Towards prevention of loss of muscle stem cell function during aging and prevention of cancer cachexia.
Schmidt M
Dissertation 2018, Jena, Germany