Um die Wechselwirkungen zwischen dem Alterungsprozess und altersspezifischen Erkrankungen zu verstehen, haben Wissenschaftler vom Jena Centre for Systems Biology of Ageing (JenAge) die bisher umfassendste Vergleichsstudie zur Alterung verschiedener Spezies und Gewebearten durchgeführt. „Mithilfe von vergleichenden, systemübergreifenden Methoden können wir komplexe biomedizinische Prozesse wie die des Alterns hervorragend erforschen“, so JenAge-Koordinator Dr. Jürgen Sühnel vom Leibniz-Institut für Alternsforschung - Fritz-Lipmann-Institut (FLI). Koordiniert wurde die Studie von Professor Christoph Kaleta von der Christian-Albrechts-Universität zu Kiel, der auch Mitglied im Exzellenzcluster „Entzündungsforschung“ ist, und Professor Eytan Ruppin von der University of Maryland, USA. Die Wissenschaftler haben Veränderungen in der Genaktivität verschiedener Organe bei Menschen, Mäusen, Zebrafischen sowie bei den kurzlebigen Prachtgrundkärpflingen der Gattung Nothobranchius furzeri im Altersverlauf verglichen. „Wir haben viele Ähnlichkeiten in Bezug auf die molekularen Signaturen von altersbedingten Veränderungen in den untersuchten Spezies gefunden. Unsere Ergebnisse weisen klar darauf hin, dass der Alterungsprozess bei sehr unterschiedlichen Wirbeltieren im Kern sehr ähnlich verläuft, obwohl die Lebensspannen der untersuchten Spezies von wenigen Monaten bis hin zu fast einem Jahrhundert reichen“, so Professor Kaleta, korrespondierender Autor der Studie.
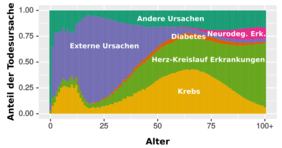
Im Anschluss verglichen die Forscher die veränderten Genaktivitäten mit den Signaturen altersspezifischer Erkrankungen. Sie fanden dabei heraus, dass die altersbedingten Veränderungen in der Genaktivität von ähnlichen Veränderungen wie bei degenerativen Erkrankungen begleitet wurden. Überraschenderweise wiesen diese Veränderungen im Vergleich zu Krebs eine umgekehrte Entwicklung auf. „Unsere Ergebnisse zeigen, dass das Altern nicht unbedingt sämtliche altersbedingten Erkrankungen fördert, sondern sehr erkrankungsspezifische Einflüsse hat“, erklärt Professor Kaleta. In der Tat könnten die unterschiedlichen Einflüsse des Alterns auf verschiedene Erkrankungen eine Erklärung dafür liefern, warum im hohen Alter die Wahrscheinlichkeit an Krebs zu sterben im Vergleich zu degenerativen Erkrankungen sinkt. Interessanterweise konnten die Wissenschaftler diesen Unterschied zwischen Krebs und degenerativen Erkrankungen auch auf Genom-Ebene feststellen: viele Risikogene, die die Gefahr des Auftretens von degenerativen Krankheiten erhöhen, schützen gleichzeitig vor Krebs und andersherum.
Während die Forscher nur darüber spekulieren können, warum die altersbezogenen Veränderungen zwischen Krebs und degenerativen Erkrankungen so gegensätzlich verlaufen, vermuten sie, dass dies mit der laufenden Anhäufung geschädigter DNA (Desoxyribonukleinsäure) in den Zellen alternder Menschen zusammenhängen könnte, die wiederum das Krebsrisiko erhöhen. Als Folge davon versucht das Immunsystem, die geschädigten Zellen zu zerstören oder einzudämmen und so die Entwicklung von Krebs zu unterbinden. Dieser Zusammenhang ist möglicherweise auch eine Ursache für die bei älteren Personen häufig beobachtete leichte chronische Entzündung, die wiederum eine degenerative Schädigung des Gewebes begünstigt. „Da die molekularen Signaturen von Krebs und degenerativen Erkrankungen in grundlegenden zellulären Prozessen so gegensätzlich sind, können die im hohen Lebensalter stattfindenden molekularen Veränderungen logischerweise auch nicht gleichzeitig gegen Krebs und degenerative Erkrankungen schützen“, erläutert Professor Ruppin von der University of Maryland. „Unsere Ergebnisse zeigen, dass die Veränderungen zwar dem erhöhten Krebsrisiko entgegenwirken, der Preis dafür jedoch ein wahrscheinlich zwangsläufig erhöhtes Risiko für degenerative Erkrankungen ist.“
Die neuen Erkenntnisse deuten also ganz klar auf eine starke Verbindung zwischen degenerativen Alterserkrankungen und Krebs hin. Von besonderer Bedeutung sind diese Ergebnisse auch im Hinblick auf die derzeitige Suche nach Behandlungsmethoden zur Umkehr von altersbedingten Veränderungen. Vor dem Hintergrund dieser neuen Erkenntnisse sollten derartige Ansätze vor allem im Hinblick auf mögliche Auswirkungen auf die Krebsentwicklung sorgfältig untersucht werden.
Originalpublikation
Aramillo Irizar, P, Schäuble, S, Esser, D, Groth, M, Frahm, C, Priebe, S, Baumgart, M, Hartmann, N, Marthandan, S, Menzel, U, Müller, J, Schmidt, S, Ast, V, Caliebe, A, König, R, Krawczak, M, Ristow, M, Schuster, S, Cellerino, A, Diekmann, S, Englert, C, Hemmerich, P, Sühnel, J, Guthke, R, Witte, OW, Platzer, M, Ruppin, E und Kaleta, C (2018): Transcriptomic alterations during ageing reflect the shift from cancer to degenerative diseases in the elderly. Nature Communications, dx.doi.org/10.1038/s41467-017-02395-2
Kontakt
Professor Christoph Kaleta
Exzellenzcluster „Entzündungsforschung“ und
Institut für Experimentelle Medizin der Christian-Albrechts-Universität zu Kiel
E-Mail: c.kaleta@iem.uni-kiel.de
Telefon: +49 (0)431 500-30340