Jena/Cambridge. Das Recyclingprogramm der Zelle ist die Autophagie; ein elementarer Bestandteil der zellulären Qualitätskontrolle und für die Aufrechterhaltung der Funktionalität der Zelle enorm wichtig. Durch den Abbau von fehlgefalteten Proteinen oder geschädigten Organellen werden negative Auswirkungen auf die Zelle verhindert. Darüber hinaus werden Nährstoffe recycelt, die somit der Zelle für den Aufbau anderer Stoffe wieder zur Verfügung stehen. Fehler in diesem Recyclingprozess können zu Krebs, neurodegenerativen Erkrankungen und einer erhöhten Infektionsanfälligkeit führen, aber auch das Altern beeinflussen.
Autophagie findet unter normalen Bedingungen nur in geringem Umfang statt. Bei Mangel an Nährstoffen, z.B. Aminosäuren, wird sie jedoch angekurbelt. Bekannt ist, dass der „mechanistic target of rapamycin complex 1“ (mTORC1), ein nährstoffsensitiver Wachstumsregulator, dabei eine wichtige Rolle spielt. Er regelt den Fluss der Makromoleküle, die für den Abbau bestimmt sind, zum „Magen der Zelle“, den Lysosomen. Doch wie erfolgt die Steuerung in Abhängigkeit vom Nährstoffgehalt des Mediums in der Zelle? Welche Proteine sind daran beteiligt?
Einblicke in Recyclingprozess der Zelle
Forscher um Dr. Alessandro Ori vom Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) in Jena gingen in Zusammenarbeit mit der Forschungsgruppe um Dr. David M. Sabatini vom Whitehead Institute des Massachusetts Institute of Technology (MIT), Cambridge, Massachusetts, USA, diesen Fragen mit Hilfe umfangreicher quantitativer Proteomanalysen genauer nach, um das „lysosomale Proteom“ unter Hemmung des mTORC1-Signalwegs umfassend zu untersuchen. Dafür analysierten sie die Lysosomen im nährstoffreichen Medium, aber auch bei Nährstoffmangel ausgelöst durch „Hunger“ an Aminosäuren und Glukose sowie durch die gezielte Hemmung der mTOR Kinase durch den Wirkstoff Torin1.
„Mit Hilfe der von der Forschungsgruppe Sabatini entwickelten schnellen LysoIP-Methode und der modernen Massenspektroskopie-Plattform der Core Facility Proteomanalyse am FLI, konnten wir die Dynamik des lysosomalen Proteoms in Abhängigkeit von der mTORC1-Aktivierung sehr genau untersuchen“, schwärmt Dr. Alessandro Ori, Juniorgruppenleiter am FLI. Das internationale Team identifizierte über 800 Proteine, die mit Lysosomen assoziiert sind. „Von den vielen Proteinen weckte das Nuclear Fragile X mental retardation-interacting protein 1 (NUFIP1) unser besonderes Interesse, da seine Häufigkeit nach der Torin1-Behandlung stark zunahm.“
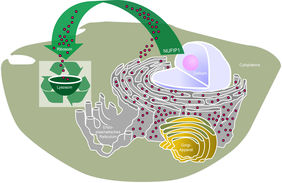
Wanderung von NUFIP1 bei mTOR-Hemmung
Das Protein NUFIP1 ist normalerweise im Zellkern lokalisiert. Jüngste Studien zeigten jedoch, dass es auch im Zytoplasma auftreten kann. Die Forscher vom MIT konnten mittels biochemischer Analysen und bildgebender Studien bestätigen, dass das Protein NUFIP1 bei der mTOR-Hemmung vom Zellkern auf Autophagosomen und Lysosomen umverteilt wird. „Beides Zellkomponenten, die bei der Autophagie eine wichtige Rolle spielen“, unterstreicht Dr. Ori die gefundenen Ergebnisse.
NUFIP1 ist wichtig, um Hunger zu überleben
Mit diesem „Schnappschuss in die Zelle“ konnten die Forscher dem Protein NUFIP1 eine neue Rolle zuweisen, da man bislang nicht wusste, dass es auch mit Lysosomen assoziiert auftreten kann. Bei Nährstoffmangel bindet NUFIP1 an intakte Ribosomen und markiert sie damit für den Abbau im Lysosom. Die Ribosomen sind die „Proteinfabriken der Zelle“. Es handelt sich dabei um große Komplexe aus Proteinen und RNA. Werden sie abgebaut, stellen sie eine der wichtigsten Nährstoffquellen dar. „Wir konnten mit unseren Studien zeigen, dass NUFIP1 für den ribosomalen Abbau bei Nährstoffmangel in Mensch- und Mauszellen notwendig ist und so das Überleben der Zelle in Hungersituationen absichert“, unterstreicht Dr. Ori.
Die Ergebnisse der Forscher aus Deutschland und USA zeigen, dass das Protein NUFIP1 unter Nährstoffmangel eine wichtige Rolle bei der selektiven Autophagie von Ribosomen in Säugetierzellen spielt. Die Studie zeigt eindrucksvoll, wie durch Untersuchung der Dynamiken organeller Proteome grundlegende Mechanismen aufgedeckt werden können, die für die Biomedizin- und Alternsforschung relevant sind.
Publikation
NUFIP1 is a ribosome receptor for starvation-induced ribophagy. Gregory A. Wyant, Monther Abu-Remaileh, Evgeni M. Frenkel, Nouf N. Laqtom, Vimisha Dharamdasani, Caroline A. Lewis, Sze Ham Chan, Ivonne Heinze, Alessandro Ori, David M. Sabatini. Science 2018, eaar2663, DOI: 10.1126/science.aar2663. science.sciencemag.org/content/early/2018/04/25/science.aar2663
Kontakt
Dr. Kerstin Wagner
Presse- und Öffentlichkeitsarbeit
Tel.: 03641-656378
E-Mail: presse@leibniz-fli.de